近日,生物材料领域顶级期刊Biomaterials在线发表了我院李草教授团队(疾病诊疗用纳米材料团队)青年教师余琦博士在抗肿瘤声纳米药物研究领域的最新进展(原文链接:https://doi.org/10.1016/j.biomaterials.2025.123381)。
声动力疗法(SDT)是一种用于肿瘤治疗的非侵入性时空调控手段,因其优异的组织穿透性和生物安全性备受关注。然而,声敏剂存在肿瘤富集效率低、活性氧(ROS)生成不足及深层穿透受限等问题,严重制约其治疗效果。如图1所示,该团队首先利用溶剂热法成功制备超小尺寸的无机声敏剂Na3TiF6NPs。结合系统表征与理论计算发现,该材料通过形成氧空位、减小带隙以及增强对H2O和O2分子的吸附能力,显著提升超声诱导的ROS生成效率。随后,将Na3TiF6NPs与近红外二区(NIR-II)荧光探针T1共同封装至酸响应基团修饰的热敏脂质体中,构建pH/光热双响应的尺寸可变聚簇纳米系统NTTD。该纳米系统在肿瘤微酸环境下通过静电作用聚集成大尺寸团簇,显著增强肿瘤滞留效果。进一步地,根据NIR-II荧光成像诊断结果,对NTTD进行激光照射,促使T1分子产生热能裂解脂质体单元,释放超小Na3TiF6NPs渗透进入深层组织,并开展深部组织SDT。
研究证实,Na3TiF6凭借肿瘤酸性微环境诱导的聚簇效应和NIR-II荧光成像优势,观察到NTTD有效富集在活体肿瘤处,并展现出高空间分辨率(494mm)和信噪比(6.95)(图2)。相比于被动靶向策略,NTTD在肿瘤处的荧光信号强度提升2.4倍,滞留时间延长达60h,为成像诊断提供了稳定的时间窗口。进一步激光照射有效提升声敏剂渗透能力至4.5倍,实现了对深部肿瘤的高效穿透与治疗,肿瘤抑制率达到75.2%(图3)。
综上所述,本文设计了一种pH/光热双响应纳米系统NTTD,这种NIR-II荧光成像指导的“酸触发聚集-光热控释”的双重尺寸转换策略,实现了诊断与治疗过程的时空精准可控,突破了声敏剂在递送效率与作用范围上的限制,有效提升了SDT治疗效用。
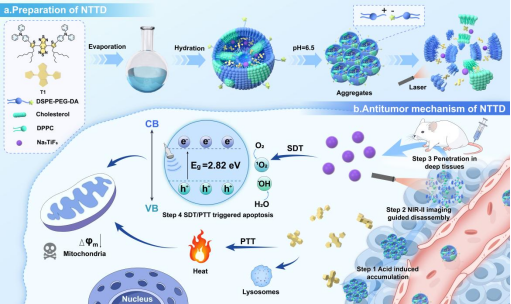
图1. NTTD的制备及NIR-II荧光成像指导的“酸触发聚集-光热控释”的双重尺寸转换策略,增敏SDT疗效的示意图

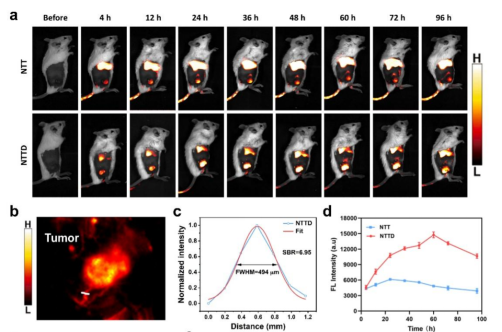
图2. NTTD近红外二窗成像诊断及活体肿瘤富集研究
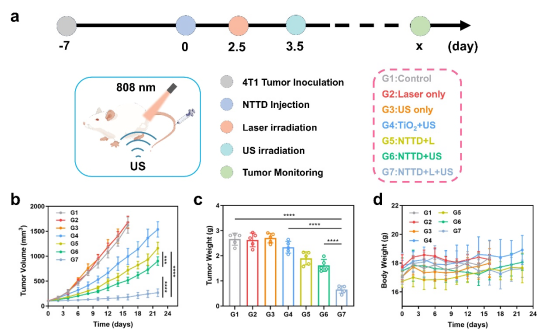
图3. NTTD在小鼠实体瘤中SDT效用
该工作以文题“NIR-II imaging guided on-site size variable clustered nanosystem to potentiate sonodynamic therapy in deep-seated tumors”发表于期刊Biomaterials。本文的第一及通讯作者余琦博士现为湖北工业大学青年教师,李草教授与华中农业大学孙耀教授为论文的共同作者和通讯作者。
据悉,李草教授带领的疾病诊疗用纳米材料团队成立于2024年3月,至今已在Advanced Functional Materials(IF 18.5,两篇)、Biomaterials(IF 12.8)、Trends in Analytical Chemistry(IF 11.8)等知名期刊以湖北工业大学为第一署名单位发表高水平论文多篇。